В методических рекомендациях рассмотрены пути экологизации естественнонаучного образования в школах нового типа. Излагается методика организации полевого и лабораторного практикума по экологии в профильных классах школы-гимназии. Методические рекомендации предназначены для преподавателей биологии, учеников средних школ и всех, интересующихся проблемами экологии и метематической статистики. Кроме того, рекомендации будут полезны работникам рыборазводных прудов. Практикум содержит атлас-определитель покоящихся стадий гидробионтов, методику экологического мониторинга ForWater, методику определения сапробности водоемов, методику определения рыбопродуктивности прудов а также методики, помогающие получать дополнительную информацию о биологии видов гидробионтов.
Методические рекомендации составлены Ведущим учителем, учителем Сороса, Орловым О.И., преподавателем школы-гимназии 102, в соавторстве с учеником Сороса по биологии, учащимся школы-гимназии 102 ,Галкиным А.В.
Научный редактор - доктор педагогических наук, кандидат химических наук, профессор, заслуженный учитель школы РТ, Курамшин И.Я.
© ВНИК "Школа-гимназия", 1997 © Орлов О. И.
К числу неотложных требований, связанных с крайним ухудшением состояния окружающей среды, относится формирование у подрастающего поколения экологической культуры, которая включает в себя не только систему знаний о закономерностях функционирования природных систем, но и понимание необходимости сохранения природы, умения прогнозировать, предвидеть последствия вмешательства человека в природные взаимосвязи, сознательное соблюдение норм воздействия на природу.
Несмотря на то, что в настоящее время разработаны временные стандарты экологического образования, издается научная и учебно-методическая литература по экологии, проблема создания системы экологической подготовки, которая эффективно работала бы в общеобразовательных школах, остается нерешенной. Это связано со многими причинами, затрагивающими как содержание экологического образования, так и его структуру и методическое обеспечение, научно-методическую подготовку учителей и учебно-материальную базу школ и др.
Нами выделены и реализованы в практике школы следующие направления экологизации учебных дисциплин, взаимодополняющие друг друга: экологизация учебных дисциплин базисного учебного плана, создание интегративных экологических факультативов, внеклассная экологическая работа.
В предлагаемых ниже рекомендациях излагается методика организации лабораторного практикума по экологии в профильных классах школы-гимназии.
Несомненный плюс данных рекомендаций состоит в том, что они являются результатом сотворчества преподавателя биологии и его ученика.
Разделы "К биологии гидробионтов Татарстана", "Методика отбора проб", "Хранение создание эталонной коллекции", "Атлас-определитель", "Методики изучения путей распространения покоящихся стадий гидробионтов", "Камеральная обработка материала", "Методика ФорВатер", Методика постановки лабораторных экспериментов", "Методика определения рыбопродуктивности прудов", "К вопросу о старении культур гидробионтов" подготовлены соро-совским учителем, ведущим учителем биологии школы-гимназии № 102 Орловым О.И.
Разделы "Сапробность", "Репрезентативность выборки", "Методы группировки данных", "Средние величины", "Показатели вариации", "Компьютерная обработка материала", "Словарь некоторых терминов и понятий" написаны учеником 11 класса (химико-биологического профиля) школы-гимназии № 102, Со-росовским учеником, победителем Второй Соросовской олимпиады школьников по биологии Галкиным А.В.
Раздел "Методика построения вариационных рядов" написан авторами совместна Все приведенные в рекомендациях лабораторные работы были успешно выполнены учениками школы-гимназии № 102.
Важное место в системе естественно-научной подготовки пренадлежит
лабораторным и практическим работам. Они служат источником знаний, основой для
выдвижения и проверки гипотез, средством закрепления знаний и умений, являются
методом контроля усвоения знаний и сформированности умений и навыков.
Практика преподавания курса биологии в 8-11 классах свидетельствует о том,
что учащиеся испытывают значительные трудности в выполнении работ
исследовательского характера, для которых основными требованиями является:
умение сформулировать рабочую гипотезу, выбрать удобный модельный объект,
пользоваться методами полевых и лабораторных исследований, правильно
математически обработать полученные результаты и в завершении оформить работу и
доложить ее на конференциях, олимпиадах.
В рекомендациях описывается содержание и методики организации практических
работ по экологии гидробионтов, а именно работы с их покоящимися стадиями.
Покоящиеся стадии, в отличие от взрослых особей, являются более удобными
объектами исследовательских работ для школьников.
Практикум представляет из себя целостную систему, не требующую обращения к
дополнительной литературе. Используя методические рекомендации практикума
возможно на уровне школы проводить длительный мониторинг водоемов, определять
сапробность, биоразнообразие, рыбопродуктивность, находить новые виды и получать
сведения об их экологии и т.д.
Авторы выражают глубокую признательность всем, оказавшим посильную помощь в
создании практикума:
Ахметзяновой Н.Ш., Зелееву Р.М., Лядовой Т.Ф., Симашеву Р.М., Ефимову В.Н.
Большинство обитающих в водоемах Татарстана беспозвоночных способны образовывать покоящиеся стадии, благодаря которым водные организмы уходят от неблагоприятного воздействия факторов среды, кроме того они выполняют важную роль в расселении вида, подобно тому, как эту роль выполняют семена большинства растений. Среди пассивно перемещающихся в толще воды и по поверхности покоящихся стадий следующих гидробионтов:

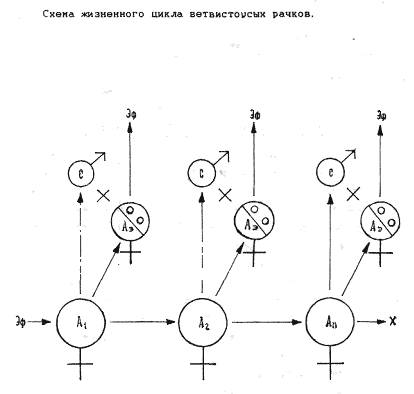
Молодь, вышедшая из эфиппиев, при наступлении благоприятных условий среды, подрастает и приступает к размножению (партеногенез). Число партеногенетических поколений может быть весьма неопределенным ( А - Аn), однако, как нами отмечено в эксперименте, чем больше число партеногенетических поколений пройдено популяцией, тем более чутко популяция реагирует на отрицательные значения факторов среды, образуя эфиппиумы даже на те колебания внешнего фактора, которые во время первоначального роста численности популяции значения не имели(старение популяции). Отрицательное значение фактора среды приводит к появлению в популяции самцов и определенного типа самок (Аэ,С), отличающиеся от обычных, продуцирующих молодь, с достоверно меньшими размерами (см. аналогично с покоящимися стадиями ракушковых рачков и циклопов). После оплодотворения самка образует на спинной стороне специальную камеру-эфиппиум, где и находятся зимовальные яйца. Таким образом предшествующий образованию эфиппиума половой процесс способствует возвращению популяции к первоначальной скорости роста. Важная роль полового размножения описывается в литературе и для многих других беспозвоночных, чьи жизненные циклы включают многочисленные этапы бесполого размножения. У простейших конъюгация возвращает культуру к первоначальной скорости роста численности. (Лемб1984) Массовое появление в планктоне эфиппиальных самок ветвистоусых рачков связано с наступлением неблагоприятных условий, однако эфиппиальные самки в пробах встречаются на протяжении всего времени существования популяции, даже тогда, когда условия для существования популяции самые благоприятные, эфиппиальные самки составляют примерно 20 из 100 половозрелых самок. Тот или иной вид после выхода молоди из эфиппиумов, занимают в водоеме свойственную им экологическую нишу. Место в экологической нише, наиболее благоприятное для размножения называется стацией, выход за пределы которой не грозит особям гибелью, но условия за пределами стации не самые благоприятные - субоптимальные. В субоптимальной зоне и происходит образование эфиппиумов.
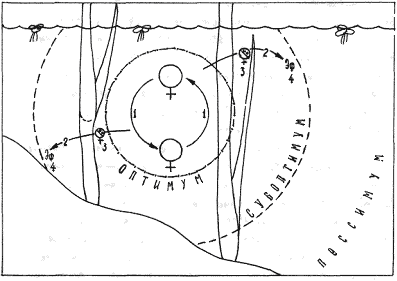
В течение сезона происходит многократное изменение условий существования
популяции, соразмерно же изменению степени пульсирует и размер стации, что
одновременно сказывается как на численности популяции, так и на количестве
эфиппиев, производимых популяцией. Одним из основных условий существования
популяции является наличие экологических ниш. Экологические ниши водоема можно
разделить на 2 группы: В первую групппу входят "стационарные" ниши, т.е.
приуроченные строго к определенному участку водоема со специфическим комплексом
физикохимических и биологических особенностей. Примером стационарной
экологической ниши может служить водоем после весеннего затопления лугов,
заросших рогозом. Со сходом воды, т.е. оголением данного участка, исчезает и
экологическая ниша, а виды гидробионтов, ее населяющие, образуют зимовальные
яйца. Ко второй группе относятся "мобильные" экологические ниши, они не так
сильно зависят от подвижек уровня воды. Примером мобильной экологической ниши
является ниша обитания ряски (поверхность слабо проточных водоемов), на которую
мало влияет уровень воды, ибо она следует вслед за ним. Большинство видов рода
Simacephalus обитает в этой нише, и само по себе наличие ряски говорит об их
присутствии. В условиях лаборатории микропопуляция Simacephalus vetulus
существовала только за счет продуктов разложения ряски, никакой другой корм в
сосуд, где находилась популяция, не вносился. Подобно видам рода
Simacephalus, отдельные виды рода Ceriodaphnia также приурочены к ряске,
однако их экологическая ниша - это столб воды под ряской и дном водоема до
глубины 1м. Другим характерным примером мобильной экологической ниши является
треугольник литорали, нижний угол которого доходит до глубины 20-30 м. Виды,
населяющие стационарные экологические ниши, появляются в пробах только тогда,
когда эти ниши заполняются водой, и уходят в эфиппии, когда уровень воды
снижается. Виды, заселяющие мобильные экологические ниши, в большей степени
зависят не от уровня воды, а от других внешних условий. Есть виды, наличие
которых в пробах носит эпизодический характер. К этим относится Moina macrocopa,
экологической нишей которой является отмель, не заросшая растительностью и с
глинистым дном, стоячего водоема. В реках этот вид встречается в массе в
затопленных водой участках поймы (май-июнь), а также в водных линзах ложа
водоема, оставшихся после схода воды (октябрь-ноябрь). Как и в первом, так и во
втором случае в популяции встречаются особи ( примерно 20 %), несущие эфиппии.
Этот же пример показывает, что первостепенным фактором, обуславливающим
существование гидробионта, является именно наличие экологической ниши, а не
температуры, как удтверждают некоторые литературные источники.
Термин
"зимовальные яйца" мало применим к покоящимся стадиям гидробионтов, хотя и
широко используется. Покоющимся ста- диям в одинаковой степени приходится
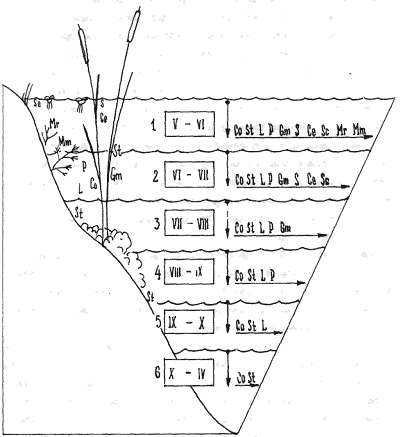
переживать как про- мораживание зимой, так и пересыхание летом. На рисунке
показаны экологические ниши доминирующих видов гидробионтов р.Казанка (левая
сторона рисунка) а также динамика образования их покоящихся стадий, в
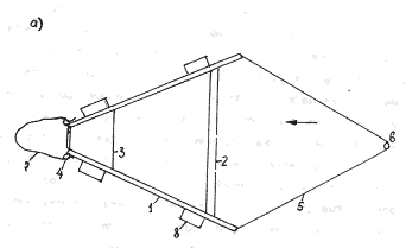
зависимости от уровня воды по месяцам (правая сторона рисунка).
| 15.05.96 Озеро Дреничное Урез воды Для "ForWater" |
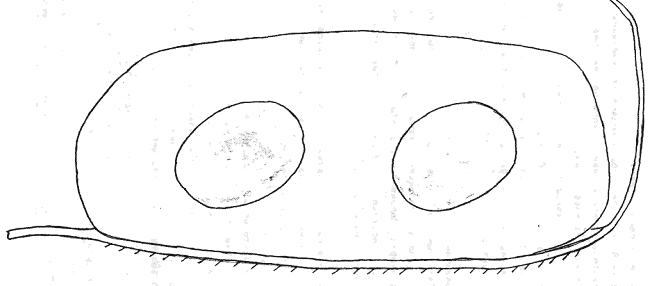
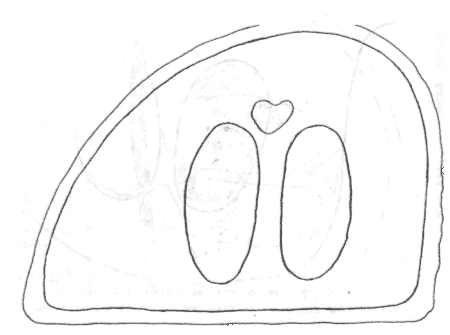
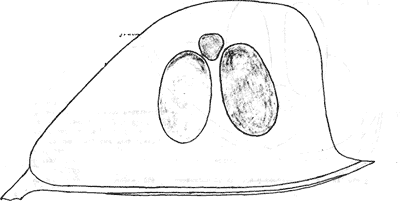
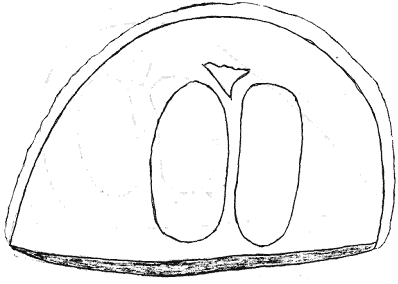
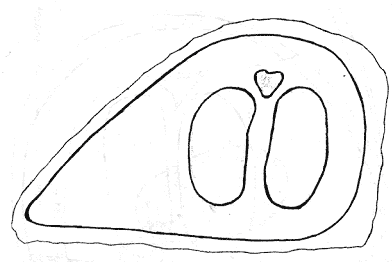
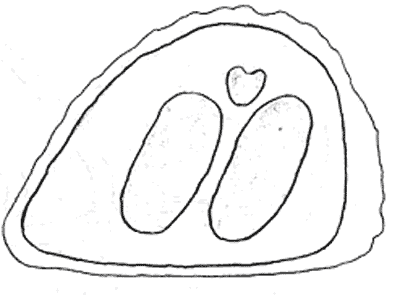
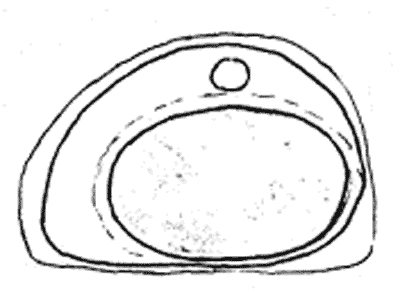
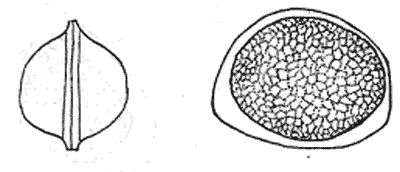
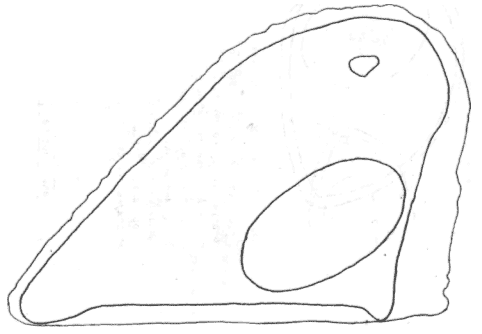
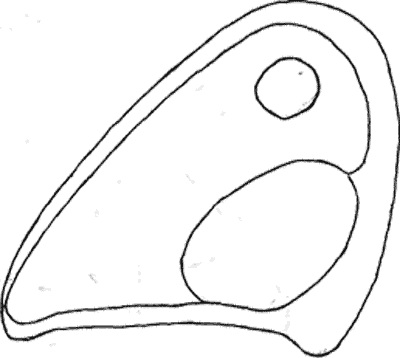
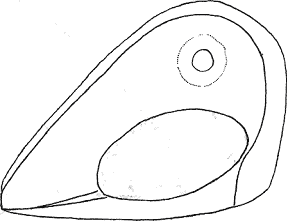
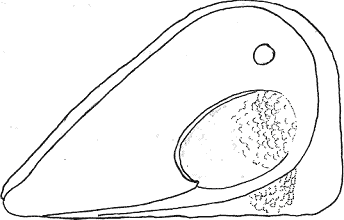
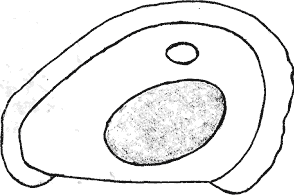
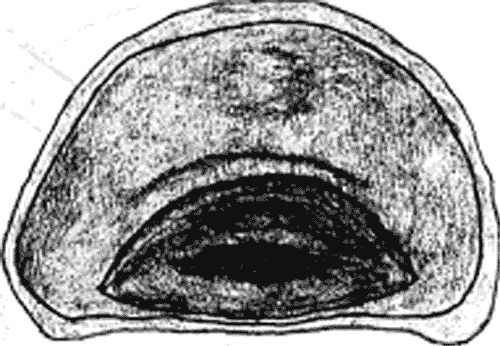
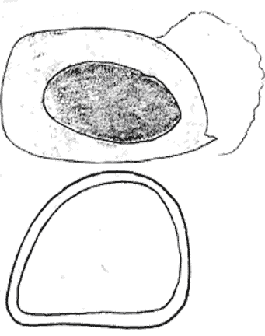
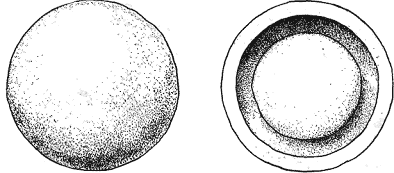
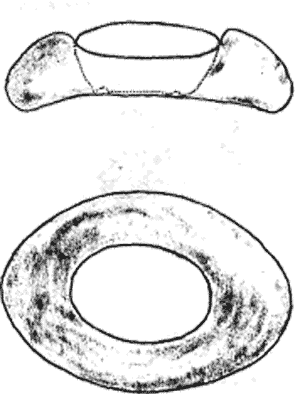
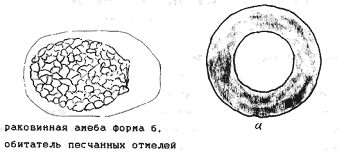
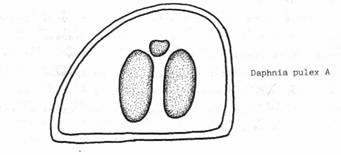
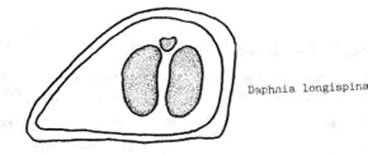
Атлас-определитель покоящихся стадий составлен для видов, встречающихся в эфиппиальных выбросах. Наиболее часто покоящиеся стадии несут в своих покровах воздушные камеры, что позволяет им всплывать на поверхность воды. Воздушные камеры могут быть первичными, т.е. образовываться непосредственно в несущих покровах, таких как оболочка, могут быть и вторичными - накладываться дополнительным слоем на оболочки. Покоящиеся стадии имеют ряд характерных черт (отличительных характерных признаков), присущих как целым родам, так и отдельным видам.
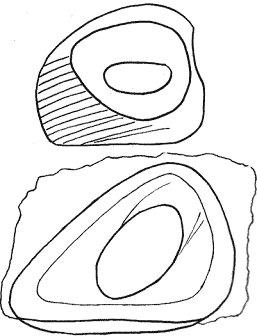
Отличительные морфологические признаки покоящихся стадий гидробионтов:
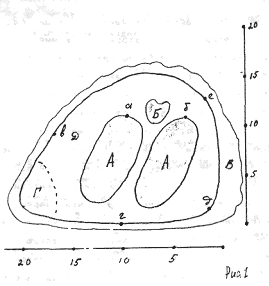
Зона А - пигментное пятно, находящееся в оболочке эфиппиума, снаружи покрывающее яйцо. У разных видов от одного до двух. Может отличаться морфологически от остальных структур.
Зона Б - пигментное пятно, под покровом которого находится воздушная камера, укутывающая изнутри зимовальное яйцо. Присутствует у большинства видов, но только у некоторых несет в себе пигмент.
Зона В - кайма, образующаяся от склеивания створок. При длительном нахождении эфиппиума на берегу обламывается. Отличается морфологически.
Зона Г - находится на задней стороне эфиппиума может отличаться от зоны Д цветом.
Зона Д - по площади занимает большую часть эфиппиума, отличается как по цвету, так и морфологически от остальных структур.
Базисные точки выделены для того, чтобы иметь возможность различать эфиппиумы разных видов при их одинаковых размерах. Например у Daphnia Pulex расстояние от А до Б, равно расстоянию от Б до Е, у других видов рода Daphnia эти расстояния не равны.
Каждый рисунок практикума сопровождается текстом, где в определенной последовательности описаны:
- характерные особености,В тех случаях, когда вид явно отличается от остальных, отдельные пункты перечня опускаются.


| Место | р.Казанка, р-н п-ка В.Гора | ||||
| Виды | 1 | 2 | 3 | 4 | 5 |
| Daphnia longispina Daphnia pulex Daphnia cucullata Simacephalus Ceriodaphnia Moina macrocopa Moina rectirostris Scapholeberis mucronata Statoblast Gemulla Прочие виды xxxxx |
28 34 16 48 13 2 16 641 722 xxxx xxxx |
50 36 11 67 12 3 8 520 911 xxxx xxxx |
xxx xxx xxx ... ... xxx xxx |
|
|
| Сумма |
|
|
|||
| р.Казанка урез воды 04.95 |
Учет на общее количество в куб. дециметре | Сумма |
| 20,20,20,20,20,20,20,20,20,14 |
|
| р.Казанка урез воды 04.95 |
Учет на общее количество в куб. дециметре | Сумма |
| |
|
| Озеро Дреничное 2-й слой от уреза воды |
Сумма | % ветвист. рачков |
% губок, мшанок | |
| Daphnia longispina Daphnia pulex A Daphnia pulex B Daphnia cucullata Simacephalus Ceriodaphnia Moina macrocopa Moina rectirostris Statoblast Gemulla Scapholeberis mucronata Прочие виды |
... . . . . |
18 25 33 8 2 1 1 34 3 2 |
13,85 19,23 25,4 6,13 1,6 0,8 0,8 - - + |
10,65 14,8 19,52 4,73 1,18 0,6 0,6 20,12 1,77 1,18 |
| Общая сумма по всем колонокам |
|
|
|
|
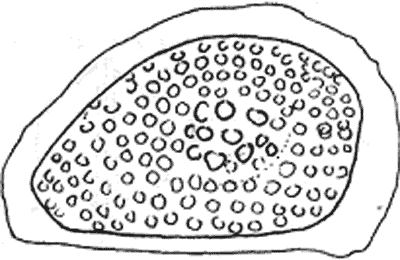
Такие виды, как Moina macrocopa и Moina rectirostris редко встречаются совместно, их эфиппиумы резко отличаются друг от друга. Статобласты мшанок, как и геммулы губок, различаются между собой в основном размерами, но их количество в сравнении с латентными стадиями ветвистоусых рачков бывает столь большим, что процент некоторых ветвистоусых рачков снижается до 5-ти и меньше, поэтому в таблицу заносят данные о процентном соотношении ветвистоусых рачков друг к другу, а в колонке 5 процентные соотношения мшанок и губок к общему количеству зимовальных яиц других видов гидробионтов. Мы полагаем, что данная последовательность видов в таблицах может быть изменена, если учет покоящихся стадий гидробионтов проводится других регионах, где возможно появление в доминантах других видов. Когда необходимости подсчета покоящихся стадий гидробионтов нет, а целью работы являяется обнаружение каких-либо видов, то счетной камерой не пользуются, вместо нее на предметный столик бинокуляра помещается чашка Петри, выступающие края которой не позволяют покоящимся стадиям гидробионтов разлетаться под действием ветра. Перемещая руками чашку Петри под бинокуляром, выявляют необходимые покоящиеся стадии.
В практике гидробиологии достаточно хорошо разработаны методики исследования состояния водоемов и проведение длительного мониторинга. Для этих целей в водоеме с той или иной регулярностью берутся пробы планктона, затем они фиксируются, а результаты получают путем обработки проб в условиях специализированной лаборатории. Определение видового состава гидробионтов на достаточно высоком уровне производится при использовании хороших оптических приборов специалистами в области тех или иных разделов гидробиологии. В условиях же школьной лаборатории проведение подобных исследований трудно выполнимо ввиду отсутствия не только необходимого оборудования, но и сколь-нибудь подходящего определителя. Определение гидробионтов по покоящимся стадиям позволяет обходиться отечественным, простым в работе бинокуляром типа МБС-1, и не требует специальных навыков и знаний даже от школьников. Тот или иной вид гидробионта занимает в водоеме свойственную ему экологическую нишу, характеризующуюся целым комплексом физико-химических и биологических факторов. Наличие вида в водоеме как раз и говорит о том, что в водоеме эти факторы имеют место. Преобладание (доминирует более 5-ти %) в водоеме большого числа видов укажет на большое разнообразие условий в водоеме, и наоборот, доминирование 2-х - 5-ти видов будет говорить об ограниченности числа экологических ниш, следствием чего может быть вывод о небольшом количестве цепей питания. Явное доминирование на фоне других видов одного или двух означает преобладание в водоеме, даже при наличии других экологических ниш, именно тех условий, которые характерны для данных видов.
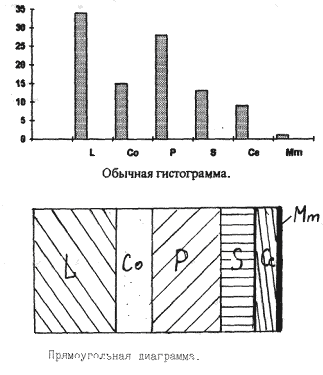
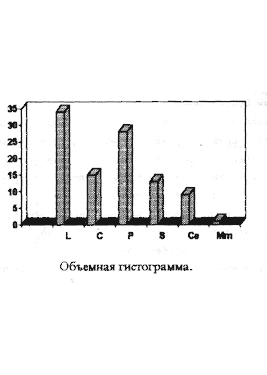
В основе методики "ForWater" (абривиатура начала английских слов FORmule of WATERsystems(формула водных систем)) заложено определение процентного соотношения покоящихся стадий гидробионтов для водоемов разного типа. Как отбирать пробы и производить первичную обработку данных детально описано в соответствующих разделах практикума. На основании полученных данных строят графики, где по оси ординат отображены проценты встречаемости тех или иных видов гидробионтов в пробе, а на оси абцисс - виды-доминанты, наиболее часто встречающиеся в водемах Татарстана, в форме условных обозначений. Присутствие вида менее одного процента обозначается знаком +. По шкале виды расположены по следующим принципам: близкородственность (L,P,Co) (S,Ce) (Mm,Mr) и схожесть экологии (St,Gm).
Текст, отмеченный "*" взят нами из определителя Мануйловой (1968), а текст, отмеченный "**" написан нами.
Зная процентное соотношение покоящихся стадий, выброшенных на берег, водоема, и биологию видов, к которым они пренадлежат, стало возможным охарактеризовать процессы, протекающие в водоеме, не беря пробы зоопланктона на протяжении сезона.
Прежде чем перейти к примерам описания водоемов по методике "ForWater", необходимо заметить общую зависимость водных систем Татарстана от имеющихся на территории республики двух крупных водохранилищ - Нижнекамского и Куйбышевского, а также от находящегося рядом с республикой Чебоксарского водохранилища. Годы, когда уровень вод водохранилища достаточно высокий и постоянный, повышается уровень вод и малых рек, втекающих в водохранилище, и, как следствие, наблюдается повышение уровня воды в пойменных озерах. Многие пойменные озера ( основной источник воды для малых рек) в этом случае имеют с малыми реками непосредственное сообщение. При высоком уровне водохранилищ наиболее полно реализуются имеющиеся экологические ниши водоемов, отсюда и большая скорость самоочистки, большая кормность рек (трофика). При низком уровне водохранилища, что наблюдается в последние годы, практически полностью отсутствуют экологические ниши в малых реках и водохранилищах для видов рода и многих других. Уменьшилось количество мест для нереста рыб, мест нагула личинок и молоди рыб. Неестественные быстрые подвижки уровня воды приводят к смертности покоящихся стадий в отдельном сезоне (весна 1996 года) до 95 %.
Примеры описания водоемов Татарстана по методике "ForWater":
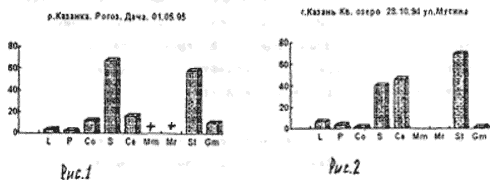
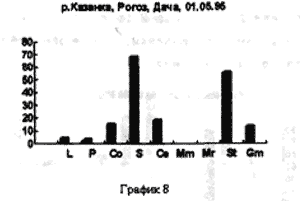
Отбор проб производили на реке Казанке в одном и том же месте, напротив рогозового залива с различной периодичностью. Пример 1 (рис. 3,4,5)/
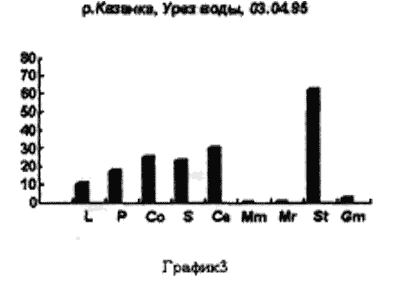
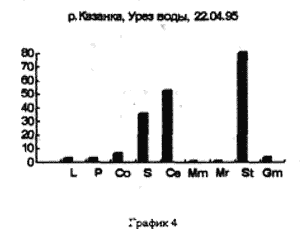
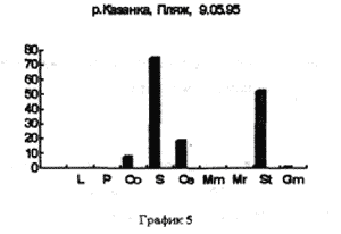
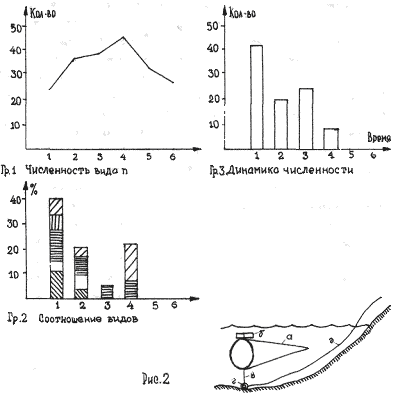
На рисунке 3 видно большое разнообразие видов, находящихся на старте (температура воды не способствует выходу молоди из покоящихся стадий). Представлены практически все виды, наиболее часто встречаемые в эфиппиальных выбросах. Рис 4 - видно явное доминирование родов Simacephalus и Ceriodaphnia, что говорит о бурном развитии ряски в прилегающих к реке заливах. Рис 5 - виды родов Simacephalus и Ceriodaphnia составляют 95 % - процесс заполнения водой мест, заросших рогозом, мелководий и других богатых биогенами участков поймы, завершен. Именно на этих участках и происходит нагул личинок и малька рыб. Пример 2 (рис. 6,7) Местом отбора проб служило устье реки Казанки, где пробы отбирались по нескольку раз в разное время.
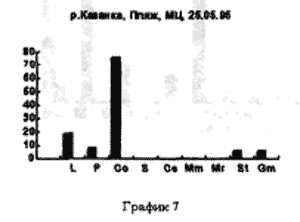
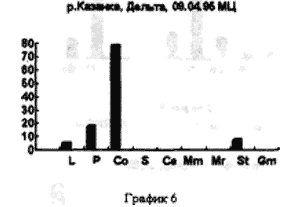
На рисунках видно, что устье реки не претерпевает по качественному и количественному составу гидробионтов каких-либо существенных изменений. На графиках заметно увеличение вследствие увеличения Daphnia longspina уровня воды и заполнения треугольника литорали. Существенных изменений не происходит и в заливе реки Казанки, заросшем рогозом (рис 8,9)
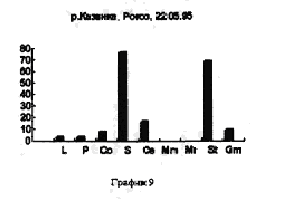
В устье рек гидробионты, чьи покоящиеся стадии попадают в эфиппиальные выбросы, в основном представлены видами D. longspina и D. cuculata, а доминирование одного из этих видов над другим зависит от уровня воды. Чем уровень выше, тем лучше выражен треугольник литорали - доминирует D. longspina , уровень падает - начинает доминировать D. cuculata.
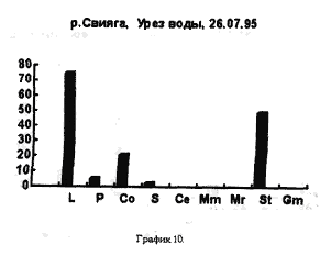
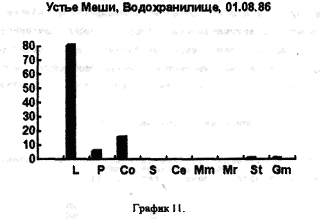
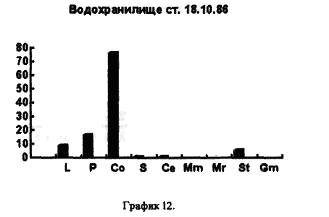
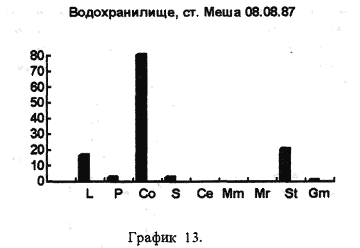
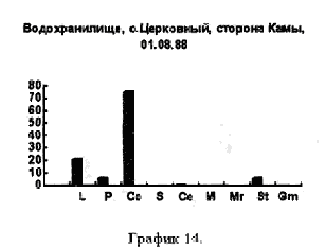
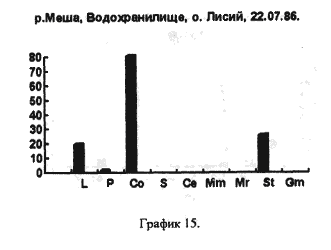
На рисунках видно, что водохранилище является вполне определенной целостной системой, т.к. каких-либо существенных сдвигов в процентном соотношении покоящихся стадий гидробионтов, выбрасываемых на берег, за три года не произошло. Однако если сравнить процентное соотношении покоящихся стадий гидробионтов в устье какой-либо реки, будь то Казанка, Свияга или Меша, то обнаружим почти полное сходство. На наш взгляд водохранилище представляет из себя не самостоятельную биологическую систему, а среднее от суммы устьев рек, впадающих в него, то есть больше устье многих рек. Доказательством этого может служит сравнение процентного соотношения покоящихся стадий гидробионтов в Куйбышевском водохранилище (рис 14) и реки Меши (остров Лисий) (рис 15).
Cамо же по себе устье реки по процентному соотношению покоящихся стадий гидробионтов схоже с озером (рис 16), с этой точки зрения водохранилище можно считать большим озером.
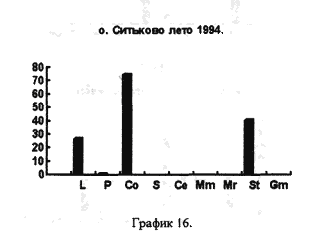
На рисунках 17,18,19 представлены процентные соотношения гидробионтов в водоемах, находящихся в черте города и загрязненных в той или иной степени человеком.
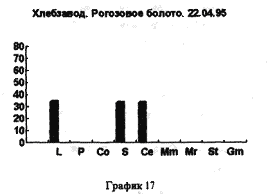
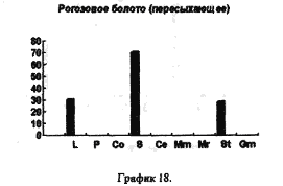
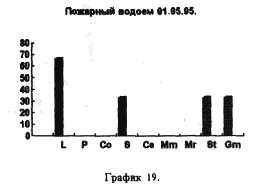
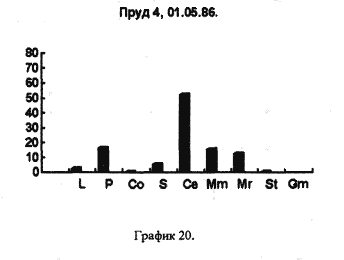
Все три графика объеденяет присутствие D. longspina и видов рода Simacephalus, что подтверждают литературные данные о том, что D. longspina способна жить в грязной воде. Ряска же, находящаяся на поверхности этих водоемов, по всей видимости создает для видов рода Simacephalus, микросреду, которая и защищает их от гибели. С другой стороны, искусственно созданные водоемы, такие как рыборазводные пруды, отличаются от любых других биотопов большим разнообразием видов и служат своего рода микрозаповедниками для многих видов гидробионтов(рис 20)
Обычно, когда речь идет о загрязнении водоемов, рек, озер, водохранилищ биогенными элементами применяются два термина для обозначения этого явления, а именно : сапробность и трофность. Степень загрязненности водоемов биогенами изменяется от слабой до очень сильной, что соответствует переходу от олигосапробности через мезосапробность к полисапробности. Животные и растения, обитающие в водоемах разной сапробности, называют сапробами (олигосапробами, мезосапробами и полисапробами).
Главным образом биоиндикация загрязнения осуществляется путем учета видовой структуры сообщества: нахождения в нем тех или иных организмов с характерной экологией (сапробов). Основателями данного метода в гидробиологии считаются Р.Кольквитц и М.Марссон, которые в 1908г. использовали принцип учета видового состава для оценки степени загрязнения водоемов. Они судили о степени загрязнения по присутствию или отсутствию в водоемах гидробионтов с разной степенью оксифильности, т.е. чувствительности их к концентрации в воде разлагающегося органических веществ и продуктов их распада. По разработанной этими ученными шкале, получившей название "шкала Кольквитца и Марссона" или "шкала сапробности" согласно которой водоемы и делятся на олиго-, мезо- и полисапробные.
Особо выделяется еще одна группа вод - катаробные воды, особо чистые (пересыщенные кислородом, отсутствует диоксид ушлерода и сероводород).
Через полвека после опробации методики сапробности, под нее была подведена математическая база. В 1955 году английские ученые Р.Пантле и Г.Бук разработали систему вычисления индекса сапробности. Каждой зоне сапробности и сапробам этой зоны было подоюрано особое числовое значение:
| олигосапробные |
|
| В-мезосапробные |
|
| А-мезосапробные |
|
| полисапробные |
|
Числoвое значение сапробности гидробионта, уникальное для вида и характеризующее особенности его экологии, называется индикаторной значимостью вида и иобозначается SДопустим, если индикаторная значимость вида равна 1.2, то значит вид обитает в олигосапробной-В-мезосапробной зоне, предпочитая все-таки олигосапробные.
Количеству же гидробионтов в пробе было соотнесено свое числовое значение (обознаечается Hi )
| случайные находки |
|
| частая встречаемость |
|
| массовое развитие |
|
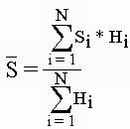
| Si | индикаторная значимость вида i |
| Hi | относительная численность вида i. |
| N | число видов-индикаторов. |
Исходная методика базируется на экологии гидробионтов, учитывая их количество, вычисление же сапробности по методике "ForWater" базируется на процентном соотношении зимовальных яиц. Переход от гидробионтов к их покоящимся стадиям не меняет сути методики, т.к. количество зимовальных яиц в эфиппиальных выбросах прямо пропорционально количеству гидробионтов, населявших данный водоем.
Однако данная математическая модель имеет большое количество недостатков:
Как это ни странно, понятие "сапробность" широко распространено только в нашей стране, в мировой практике гидробиологии оно редко используется, так как является больше химической, нежели биологической характеристкой водоемов, хотя и определяется по гидробионтам. За рубежом в основном используют понятие трофности водоемов, понимая под этим термином насыщенность водоема биогенами. Согласно Б.Небелу (1993) различают олиготрофные, или бедные биогенами, условия, и эвтрофные, соответственно богатые биогенами, условия.
Сапробность и трофность - два термина, характеризующих нарушение экологического равновесия в водоемах вследствие обогащения их биогенами, имеют, тем не менее, разный смысл из-за различного подхода к механизму этого нарушения. Сапробность рассматривается как загрязнение водоемов вследствие разложения органики, привнесенной в водоем с промышленными и бытовыми стоками, в то время, как повышение трофности - эвтрофизация водоемов - естественный процесс обогащения водоемов биогенами, за счет выноса в водоем почвенных частиц, удобрений и естественной эвтрофизации.
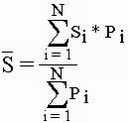
| Si | индикаторная значимость вида |
| Pi | частота встречаемости вида |
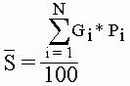
Точность проведенных вычислений расчитывается по формуле
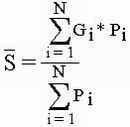
| Gi | индикаторная значимость вида |
Особенностью данного метода является его высокая точность : если в
классическом случае частота встречаемости определяется чисто эмпирически исходяя
из следующих соображений:
5 - активно размножается
3 - массово
встречается
1 - присутствует в "плюсах",
то в нашем же случае частота
встречаемости расчитывается математически, на основе формул
водоемов.
| Виды или рода | Количество в пробе |
| Daphnia Longispina | 411 |
| Daphnia Pulex morph.A | 188 |
| Daphnia Pulex morph.B | 99 |
| Daphnia Cucculata | 294 |
| Statoblast | 34 |
Расчитываем частоту выборки по формуле:
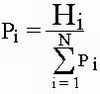
получаем следующие результаты:
| Виды или рода | Частоты встречаемости |
|---|---|
| Daphnia Longispina | 411/1026 = 40% |
| Daphnia Pulex morph.A | 188/1026=18.3% |
| Daphnia Pulex morph.B | 99/1026=9.66% |
| Daphnia Cucculata | 294/1026=28.6% |
| Statoblast | 34/1026=3.31% |
Расчитываем сапробность на основе таблицы сапробности:
| Роды и виды | Индикаторная значимость вида |
|---|---|
| Daphnia Longispina | 2.05 |
| Daphnia Pulex morph. A | 2.80 |
| Daphnia Pulex morph. B | 0.50 |
| Daphnia Cucculata | 1.70 |
| Statoblast | 2.10 |
Расчитываем сапробность водоемов по формуле, указанной в начале:
S = (2.05 * 40 + 18.3 * 2.8 + 9.66 * 0.5 + 28.6 * 1.7 + 3.31 * 2.1) / 100 = 1.93641
| Сапробность водоемов | Количественная характеристика |
|---|---|
| Х - сапроб | менее 1 |
| Олигосапроб | 1.0-1.5 |
| О-В мезосапроб | 1.5 - 2.0 |
| В-мезосапроб | 2.0 - 2.5 |
| В-А мезосапроб | 2.5 - 3.0 |
| А-мезосапроб | 3.0 - 3.5 |
| А-П сапроб | 3.5 - 4.0 |
| Полисапроб | более 4 |
| Место взятия проб | Дата | Сапробность |
|---|---|---|
| 1.Куйбышевское водохранилище, о-ва, стационар |
08.86 | 2.0125 (В) |
| 2.Куйбышевское водохранилище, о-ва.(свежий выброс) |
08.86 | 2.025 (В) |
| 3.Куйбышевское водохранилище | 17.08.87 | 1.82 (О-В) |
| 4.Куйбышевское водохранилище | 17.08.87 | 2.5 (А-В) |
| 5.Куйбышевское водохранилище | 10.87 | 2.51 (А) |
| Место взятия проб | Дата | Сапробность |
|---|---|---|
| 1.Река Казанка (озеро) | 05.05.88 | 1.6 (В-О) |
| 2.Река Казанка, пляж | 01.04.95 | 1.52 (В-О) |
| 3.Река Казанка | 01.04.95 | 1.7 (В) |
| 4.Река Казанка | 03.04.95 | 1.811 (В-О) |
| 5.Река Казанка | 22.04.95 | 1.51 (В-О) |
| 6.Река Казанка, рогоз | 22.04.95 | 1.55 (О-В) |
| 7.Река Казанка, рогоз, дача | 01.05.95 | 1.574 (О-В) |
| 8.Река Казанка,пляж, мост | 09.05.95 | 1.52 (В-O) |
| 9.Река Казанка,пляж, Молодежный Центр |
25.05.95 | 1.8 (О-В) |
| Место взятия проб | Дата | Сапробность |
| 1.Пруд 1 | 05.87 | 1.85 (В-О) |
| 2.Пруд 1 | 07.87 | 1.64 (О-В) |
| 3.Пруд 2 | 11.10.86 | 1.55 (О-В) |
| 4.Пруд 3 | 05.87 | 0.96 (Х-О) |
| 5.Пруд 4 | 2.127 (В) |
| Место взятия проб | Дата | Сапробность |
| 1.Река Меша,водохранилище, о-в. Лисий |
22.08.86 | 1.3 (О) |
| 2.Озеро Дреничное | 10.10.95 | 2.1 (В) |
| 4.Озеро Ситьково | 06.94 | 1.775 (О-В) |
| 5.Дача.Озеро. | 05.05.88 | 1.68 (О-В) |
Данные, полученнные нами по сапробности, полностью совпадают с данными, полученными экспедициями КИБ АН Татарстана.
Измеряемым параметром, который используется для построения вариационных рядов в тематике практикума является размер покоящихся стадий. Размер гидробионта является его видовой характеристикой и колеблется в определенных пределах, применительно к конкрентому региону. Максимальный размер покоящейся стадии может быть у особей, достигших наибольшего размера, т.е. чем больше размер особи, тем крупнее зимовальное яйцо. У планктонных гидробионтов наибольший размер особи достигается в благоприятных условиях, таких как: оптимальная темпиратура, наличие корма, скорости тока воды и т.д. На размер покоящейся стадии гидробионта, относящейся к перифитону, кроме вышеперечисленных факторов также влияет наличие субстрата и его качество.
Первым этапом работы является измерение под бинокуляром 200 экземпляров ( в школьной практике достаточно 100 ) покоящихся стадий одного вида гидробионта. Перед измерением настраивают бинокуляр, в один из тубусов вставляется обычный бинокуляр х8, в другой - бинокуляр х8 с измерительной шкалой. Поочередно каждый экземпляр покоящейся стадии фильтратора помещается под измерительную шкалу, но в центральную ее часть.
Пример: 18, 16, 17, 17, 15, 16, 17, 20, 19, ....
Следующий этап работы - определение шага вариационного ряда. Он определяется по следующей формуле :
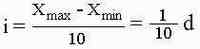
Продолжая предыдущий пример получаем шаг вариационного ряда :
i = (20 - 15) / 10 = 0.5
Когда шаг вариационного ряда определен, приступают к составлению шкалы вариационного ряда, где отсчет ведется с самой малой величины ( нулевого класса )
| Классы | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Значения | 15 | 15.5 | 16 | 16.5 | 17 | 17.5 | 18 | 18.5 | 19 | 19.5 | 20 |
Однако если сейчас внимательно присмотреться к нашей выборке и к шкале вариационного ряда, то можно заметить, что предел измерения в выборке составляет 1.00 а у нас получился шаг меньше предела измерения. В этом случае все идет как обычно, только частоты промежеточных классов, где получается 0, берутся не из выборки, а интерполируют методом средней, т.е. берут среднее арифметическое двух соседних классов. Но не надо это путать с тем случаем, когда действительно мало выражен какой-либо класс (об этом говорит то, что шаг вариационного ряда больше предела измерения)
Следующим немаловажным этапом работы является составление рабочей таблицы, где первыми двумя профилями являются шкалы вариационного ряда, в третий профиль заносят частоты.
Пример:
| Классы | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Значения | 15 | 15.5 | 16 | 16.5 | 17 | 17.5 | 18 | 18.5 | 19 | 19.5 | 20 |
| Частоты | | | | | |||||||
| Сумма | 1 | 12 | 23 | 26 | 41 | 34 | 22 | 39 | 8 | 9 | 10 |
Таблица заполняется следующим образом. По порядку в столбце измерений карандашом отмечаются цифры, а их значения заносятся в таблицу в форме точек и черточек. Например, если цифровое значение измерения - 15.1, точка ставится в классе 1, т.к. эта цифра больше 15 но меньше 15.5. Если цифровое значение измерения - 18.7, то точка ставится в класс 8, т.к. она больше 18.5, но меньше 19. Когда в каком-либо классе появляются две цифры, в нем ставятся две точки , три точки четыре точки , когда же заносится пятая величина между точками проводится одна черточка ( ), шестая - две ,седьмая три , восьмая - четыре , девятая пять , десятая величина завершает цикл.
Результат подсчета (Z) для каждого класса определяется количеством заполненных квадратов , находящихся в столбце. Завершающим этапом работы является построение графика вариационного ряда. На оси абцисс отмечаются классы , по оси ординат - цифры немногим более максимальной суммы среди сумм разных классов.
Пример N 4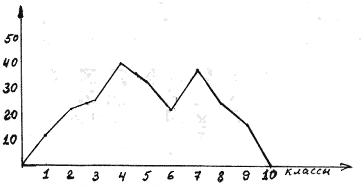
Вариационным рядом называется ряд чисел, показывающий закономерность распределения единиц изучаемой совокупности по мере возрастания (или убывания) значений вариационного признака. Рабочей гипотезой любого вариационного ряда является кривая Гаусса, т.е. количество особей, несущих среднее значение признака всегда больше особей, отклоняющихся от среднего значения.
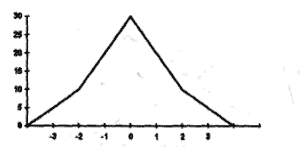
Всевозможные отклонения от кривой Гаусса могут подсказать о тех процессах, которые происходят в той или иной биологической системе , например вариационный ряд выглядит следующим образом :
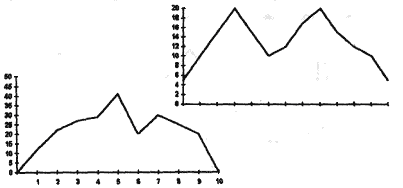
Следовательно, мы имеем на графике не одну кривую Гаусса , а две. В этом случае можно сделать вывод об идущих популяции двух независимых процессов. Так как одним из изучаемых признаков является величина зимовального яйца , а согласно рабочей гипотезе особей со средним значением должно быть больше по численности , значит мы имеем дело с двумя разными видами ( именно благодаря этому методу был обнаружен новый подвид Другой пример - график смещен либо вправо (1), либо влево (2).
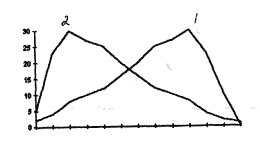
Данные графиков говорят о доминировании одной из размерных форм, что позволяет искать причины "выпадения" особей несущих ту или иную крайнюю форму. Третьим вариантом является тот случай, когда на одной кривой наблюдается два пика.
Объектом изучения в биологии, как правило, является какая-либо совокупность особей (популяция). Научные наблюдения могут проводится как и над всеми членами изучаемой совокупности, так и над какой-либо ее частью. Конечно, наиболее точную информацию о биологическом объекте-популяции можно получить лишь изучая всех ее членов, но, как правило, такая степень точности избыточна, и достаточно подвергнуть наблюдениям лишь какую-то часть исходной совокупности, а затем, проанализировав результаты, обобщить их на всю совокупность (т.е. индуцировать). При этом вся совокупность, часть которой подвергается наблюдениям, называется генеральной совокупностью, а та ее часть, которая отбирается из общего количества для проведения исследований - выборочной совокупностью или выборкой. В биометрии генеральная совокупность обозначается N, а выборочная - n. Однако во многих местах данной книги Вам будет встречаться N там, где по идее должно быть n, в данных случах эти две величины считаются равноправными.
Пример:
Верхний слой эфиппиев некоего пруда содержит 1.3 е+18 эфиппиев
(читается : 1.3 на десять в 18-й). Для проведения наблюдений мы отбираем 1000
штук, следовательно, генеральная совокупность N=1.3e+18, а выборка - 1000.
Следует, однако отметить, что зачастую нет возможности точно определить N, так оно либо слишком велико либо постоянно меняется, так, скажем, нельзя точно определить количество живших в течение летнего сезона в водоеме фильтраторов, поэтому N определяется как стремящееся к бесконечности. Метод анализа выборки с дальнейшим обобщением этого анализа на всю генеральную совокупность называется выборочным методом. Характеристики, полученные анализом выборочной совокупности, как правило позволяют нам довольно точно судить о всей генеральной совокупности, однако эти характеристики несколько (все зависит от объема выборки и от степени ее рандомизации (случайности или разбросанности)) отличаются от истинных характеристик объекта. Степень соответствия характеристик выборки истинным характеристикам биологического объекта (генеральной совокупности) и называется репрезентативностью выборки. Мы придерживаемся следующего ее обозначения Rp, затем в виде префикса, внизу строки, параметр, по которому расчитывается репрезентативность, и в скобочках величина выборки (n).
Пример :
В аквариуме некоторое время жил Simacephalus vetulus. К
осеннему сезону общее число эфиппиев, образованное популяцией, было 2417 штук.
Проанализировав 100 штук мы нашли, что их средний размер был равен
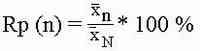
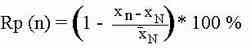
Rp (n=100) = (20.04154360 / 20.100011)*100 % = 99.711 %
Rp (n=1000) = (1 - (20.111824 - 20.100011) / 20.100011) * 100 % = 99.94123 %
Аналогичным образом вычисляется репрезентативность и других характеристик. В принципе, для достаточно точной характеристики достаточно Rp=98 %. В научной работе как правило, репрезентативность не вычисляют, а лишь ссылаются на нее, говоря, что "репрезентативность выборки была достаточной" или используют ошибку репрезентативности (см. ниже).
Любые статистические данные очень трудно подвергаются визуальному анализу, если они представлены в хаотическом виде. Для того, чтобы данные были удобочитаемы и наглядны, применяют группировку данных. Если для группировки берутся непосредственно входные данные какого-либо эксперимента, то они называются первичными, если результаты первого эксперимента - вторичными, второго - третичными и т.д. Вторичные, третичные и другие рода данных, расположенные выше в иерархической лестнице мы будем называеть результатами.
Пример: При анализе эфиппиальных выбросов с разных точек на озере Раифском( Раифское отделение Волжско-Камского заповедника) выборка составляла 1230 штук, на острове Лисий - 1134 штуки, на острове Церковный - 1452 штуки, на берегу реки Казанки около ж/д моста - 1324. Составляем таблицу- вектор :
| Место взятия пробы | Выборка |
| Озеро Раифское | 1230 |
| Остров Лисий | 1134 |
| Остров Церковный | 1452 |
| Река Казанка | 1324 |
Наиболее часто данные объеденяют в таблицы - матрицы MxN, в которых в самом верхнем горизонтальном поле записано название колонок, а в самом первом вертикальном столбике - названия строк.
Пример: В дополнение к первой таблице-вектору добавляем колонку о времени взятия пробы (таблица все еще остается вектором), и средней величине эфиппий.
| Место взятия пробы | Время отбора | Выборка | Средн. |
| Озеро Раифское | 20.05.87 | 1230 | 25.12 |
| Остров Лисий | 12.08.87 | 1134 | 24.11 |
| Остров Церковный | 14.08.87 | 1452 | 24.03 |
| Река Казанка | 22.05.95 | 1324 | 20.00 |
После группировки первичных данных и их анализа, получают, как правило, большое количество результатов ( вторичных данных ). Поэтому после проведения научной работы проводят группировку результатов. Здесь существует несколько различных методов, в зависимости от типа результатов.
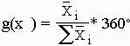
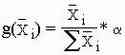
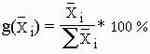
При использовании метода построения круговой диаграммы об отношении результатов судят по отношению прощадей секторов получившейся диаграммы или по углу шарового сектора, используя прямоугольную диаграмму анализируют отношение площадей получившихся отдельных прямоугольников к друг другу. В случае гистограммы результатаы относятся друг к другу как высоты прямоугольников.
Пример:
В результате анализа пробы реки Казанки 15.06.94 были обнаружены
следующие виды :
| Вид или род | Количество |
| Daphnia longispina | 258 |
| Daphnia cucullata | 112 |
| Daphnia pulex | 218 |
| Simacephalus | 102 |
| Ceriodaphnia | 68 |
| Moina macrocopa | 11 |
| Общая сумма | 769 |
| Вид или род | Количество |
| Daphnia longispina | 258 |
| Daphnia cucullata | 112 |
| Daphnia pulex | 218 |
| Simacephalus | 102 |
| Ceriodaphnia | 68 |
| Moina macrocopa | 11 |
| Общая сумма | 769 |
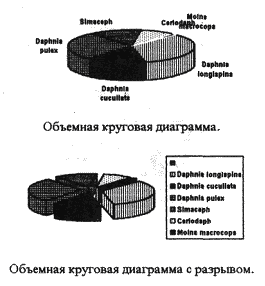
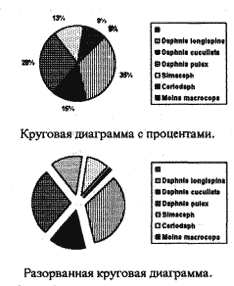
| Вид или род | Количество | |
| Daphnia longispina | 258/769 = 33.55 % | 258 |
| Daphnia cucullata | 112/769 = 14.56 % | 112 |
| Daphnia pulex | 218/769 = 28.34 % | 218 |
| Simacephalus | 102/769 = 13.26 % | 102 |
| Ceriodaphnia | 68/769 = 8.84 % | 68 |
| Moina macrocopa | 11/769 = 1.45 % | 11 |
| Общая сумма | 100 % | 769 |
Как вы уже могли заметить ранее у всех трех методов много общего, вот мы и пришли к развилке, дальше идет лишь построение по данной таблице всех видов диаграмм.

Для сравнения различных выборок используют различного рода статистические характеристики, вычисляемые путем математического анализа. Одной из наиболее изпользуемой статистической характеристикой, использукмых в биометрии, является средняя арифметическая. Она показывает, в частности, какой средний размер имеют особи в изучаемой совокупности, что позволяет судить об условиях их местообитания, и особеностей жизни.
По определению Гаусса. истинной среднеей , обозначаемой X служит такая величина. скмма квадратов отклонений от которой наименьшей, но на практике используют более простые формулы.
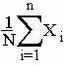
В тех случаях, когда вы уже построили таблицу частот повторяемости того или иного признака, то можно провести расчет взвешенной средней арифметической.
Пример:
При анализе эфиппий со Стационара (Куйбышевское водохранилище)
были получены следующие данные для Ceriodaphnia :
17,19,21,18,19,18,18,17,19,20,21,20,20
Вычисляем среднюю арифметическую (17+19+21+18+19+18+18+17+19+20+21+20+20)/13=19Когда в качестве исходных величин используются квадраты неких чисел
(например для площадей) используется средняя квадратическая, расчитываемая как
:
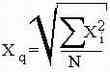
Используется, когда в качестве исходной совокупности используют обратные величины.
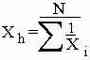
Используется для определения средней, когда в качестве исходных данных используются кубы чисел (при расчете среднего объема).
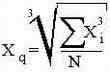
Общая для всех средних, используется, когда в качестве исходной совокупности используется ряд степеней n-го порядка другой совокупности. Общая формула:
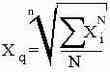
При n = 1 получается средняя арифметическая
n = 2 - средняя
квадратичная
n = 3 - средняя кубическая
n = -1 - средняя гармоническая.
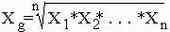
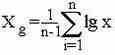
Пример:
В аквариум посадили Daphnia Magna в количестве 3 штук. После
этого экспоненциальный рост численности популяции продолжался согласно
следующей таблице. Какая в среднем скорость прироста в день ?
Сначала
находим относительную величину прироста в день:
| Время | Кол-во | Относит. величина |
| 1 день | 3шт. | ------- |
| 2 день | 6шт. | 6/3=2 |
| 3 день | 18шт. | 18/6=3 |
| 4 день | 41шт. | 41/18=2.27 |
| 5 день | 114шт. | 114/41=2.78 |
| 6 день | 256шт. | 256/114=2.245 |
Зачастую бывает так, что у на вариационном ряду явно прослеживаются два пика, и среднее арифметическое попадает в "провал" между ними. При этом могут имеються две выборки, имеющие абсолютно одинаковые лимиты, размах вариации и среднее арифметическое, но вариационные ряды которых резко отличаются : у одной может быть только один пик, на который и приходится среднее арифметическое, у другой же - два пика, и среднее арифметическое приходится на провал. Каким же образом определить насколько близко к истинному пику средняя арифметическая, не строя вариационный ряд ? Для этого вычисляют : насколько каждая из величин выборки отличается от средней, и чем больше получается полученная величина, тем сильнее рессеяние выборки. Если руководствоваться данными умозаключениями, то формула для вычисления отклонения должна была бы быть
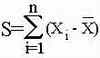
Однако полученная величина не будет точно отражать степень варьирования признака, так так при увиличении объема выборки, будет неизменно расти, поэтому разумнее было бы привязать эту величину к объему выборки таким образом, чтобы она не зависила от объема выборки. Самое простое - разделить полученную величину на объем выборки.
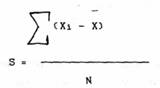
Данная формула как раз и используется в социологии, когда анализируются данные различного рода демографические показатели, а в биометрии в основном используется в качестве знаменателя не N, а N-1, так называемое число степеней свободы вариации (впервые этот термин ввел в биометрию Фишер). Понять его довольно сложно. Допустим у нас имеется некая выборка и мы расчитываем расброс ее вариант. Первая величина этой выборки может быть любой, вторая тоже, третья... и так до последней. Последняя величина строго определена таким образом, чтобы средняя арифметическая, вычисленная по данной выборке, не изменилась.
Пример: У нас имеется выборка : 5,10,15. Средняя арифметическая : (5+10+15)/3=10 Попытаемся составить вторую выборку имеющую другие значения вариант, но обладающую той же средней арифметической. Возьмем первое число 20, второе 40. Следующее число мы уже не можем взять просто так, так как от этого может изменится среднее арифметическое. Так как в сумме все три числа должны составлять 30 ( среднее арифметическое, умноженное на объем выборки), то последнее число будет равно 30-40-20=-30. Таким образом свободно можно выбрать только N-1 величин, где N - объем выборки. Это и есть число степеней свободы. Исходя из всего этого у нас получается следующая формула:
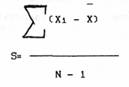
Так как заранее неизвестно сколько классов находится левее или правее средней арифметической, т.е. сколько чисел в выборке меньше средней арифметической, а сколько больше, но точно известно, что некоторые из них меньше средней арифметической, то часть слагаемых будет отрицательными и величина отклонения будет неправильной. Поэтому суммируют не разности между каждой отдельной вариантой и средней арифметической, а их квадраты, которые всегда положительные. Получилась формула :
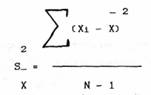
Данная величина называется в биометрии средним квадратом отклонений, или дисперсией, или вариансой. Дисперсия выборки обозначается SX2, OX2 - дисперсия генеральной совокупности.
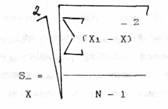
Т.к. в результате вычисления дисперсии получилась величина, представляющая собой некие квадраты, данные величины можно сравнивать только между собой, но нельзя судить об отношении дисперсии к средней арифметической. Поэтому из полученной диспервии извлекают квадратные корень, чтобы размерность полученной величины совпала с размерностью средней арифметической.
Степень варьирования признака очень зависит от средней арифметической. Допустим среднеквадратичное отклонение SX= 5.0255 при средней арифметической равной X = 7. Должно насторожить, так как очень большой размах вариации, а при среднем арифметическом X = 40 это не так сильно выражено, так как сама по себе средняя арифметическая представляет собой большое число. Поэтому наряду с средним арифметическим вычисляют и коэфицент вариации, который представляет собой процентное соотношение среднеквадратичного отклонения к средней арифметической.
| V= | SX | * 100 % |
| -------- | ||
| X |
Ветвистоусые рачки рода Daphnia в рыбоводных прудах представлены четыремя видами: D. pulex tatarica, D pulex pulex, D longspina,, D cuculata. (на рисунках изображены их покоящиеся стадии - эфиппиумы). Каждый из перечисленных видов обитает в свойственных для него условиях трофности (кормности) водоема. Населяющие водоем гидробионты на протяжении всего сезона образуют покоящиеся стадии, которые остаются на берегу после схода воды. По покоящимся стадиям можно определить: какие гидробионты населяли водоем и, как следствие - условия трофности. На практике установлено, что процентное соотношение двух видов: D.pulex pulex и D pulex tatarica является показателем трофности водоема.
D. pulex pulex (а) - населяют мезотрофные (кормные) водоемы,Для расчета показателя трофности необходимо проделать следующее:
Осуществляется путем сбора с берега (лучше с угла водоема) покоящихся стадий гидробионтов в полиэтиленовые пакеты (собирается выброшенный на берег шлак - остатки растений, ряска и т.д.) В условиях лаборатории содержимое пакетов сушится, после чего просеивается сквозь сито с размером ячеи 2.5 мм. Прошедшие сквозь ее покоящиеся стадии складываются в любую тару и хранятся.
Часть собранных покоящихся стадий выкладывается на предметное стекло и просматривается под микроскопом МБС-1, при этом количество встреченных эфиппиумов "а" и "б" отмечается в следующей таблице (пример). Для достоверности результатов достаточно обнаружить 300 штук "а" и "б" в сумме. При должном навыке эфиппиумы сразу помещаются под стекло и подсчитываются (экспресс-метод).
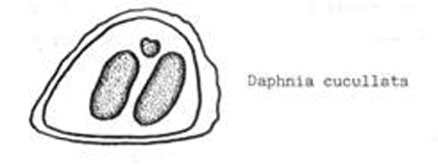
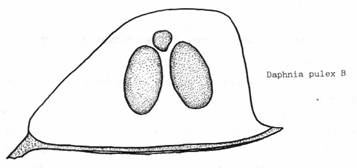
| D.pulex pulex а |
D.pulex tatarica б |
а/б |
| 223 | 77 | 223/77 = 3/1 |
В случае регистрации в водоеме низкой трофности проводят обычные мероприятия, такие как:
Настоящая методика составлена по результатам 3-х летней работы в р/х Сакуры Лаишевского района Республики Татарстан